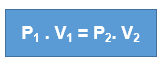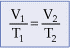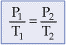Dicas importantes e os conceitos sobre o estudo dos Gases e suas aplicações

Você sabe como os gases se comportam?
E além disso, você tem ideia do que costuma ser cobrado nos concursos públicos sobre este assunto?
Verifique a seguir o que você precisa ficar atento para sair bem nas questões.
O estudo do comportamento dos gases deve ser feito sempre a partir de suas três variáveis de estado: pressão, temperatura e volume.
Equação geral dos gases
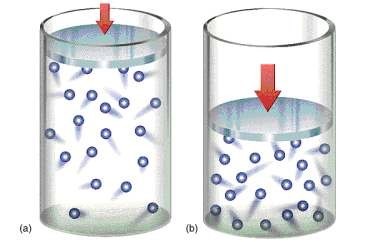
Todo gás é constituído de partículas (moléculas) que estão em contínuo movimento desordenado. Esse movimento de um grande número de moléculas provoca colisões entre elas e, por isso, sua trajetória não é retilínea num espaço apreciável, mas sim caminham em ziguezague. Essas colisões podem ser consideradas perfeitamente elásticas. O estado em que se apresenta um gás, sob o ponto de vista microscópico, é caracterizado por três variáveis: pressão, volume e temperatura. São denominadas variáveis de estado.
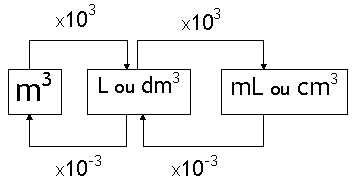
I. Volume
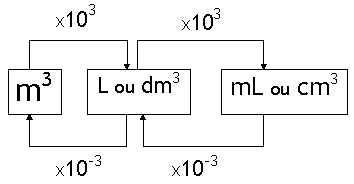
O volume de qualquer substância é o espaço ocupado por esta substância. No caso dos gases, o volume de uma dada amostra é igual ao volume do recipiente que a contém. As unidades usuais de volume são:
– litro (L),
– mililitro (ml),
– metro cúbico (m3),
– decímetro cúbico (dm3) e
– centímetro cúbico (cm3).
II. Temperatura
É a medida do grau de agitação térmica das partículas que constituem uma substância. No estudo dos gases, é utilizada a escala absoluta ou Kelvin (K) e, no Brasil, a escala usual é a Celsius ou centígrado (°C). Portanto, para transformar graus Celsius (t) em Kelvin, temos:
III. Pressão
A pressão é definida como força por unidade de área. No estado gasoso, a pressão é o resultado do choque de suas moléculas contra as paredes do recipiente que as contém. A medida da pressão de um gás é feita através de um aparelho chamado manômetro. O manômetro é utilizado na medida da pressão dos gases, dentro de recipientes fechados.
Leis Físicas dos Gases
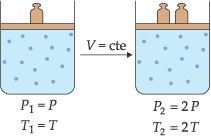
Uma dada massa de gás sofre uma transformação quando ocorrem variações nas suas variáveis de estado. Começamos o estudo modificando-se apenas duas das grandezas e a outra se mantém constante.
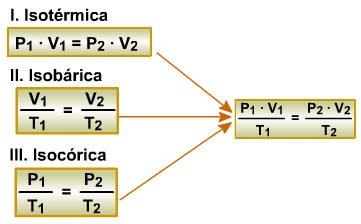
Lei de Boyle-Mariotte
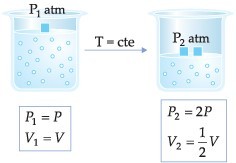
“À temperatura constante, uma determinada massa de gás ocupa um volume inversamente proporcional à pressão exercida sobre ele”.
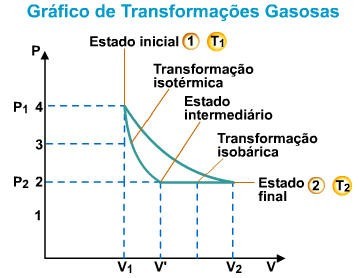
Esta transformação gasosa, onde a temperatura é mantida constante, é chamada de transformação isotérmica.
Experiência da Lei de Boyle-Mariotte
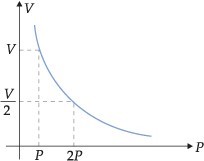
A lei de Boyle-Mariotte pode ser representada por um gráfico pressão-volume. Neste gráfico, as abscissas representam a pressão de um gás, e as ordenadas, o volume ocupado.
A curva obtida é uma hipérbole, cuja equação representativa é PV = constante. Portanto, podemos representar:
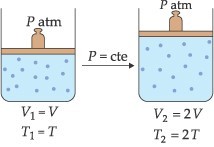
Lei de Charles/Gay-Lussac
“À pressão constante, o volume ocupado por uma massa fixa de gás é diretamente proporcional à temperatura absoluta.“
Esta transformação gasosa, onde a pressão é mantida constante, é chamada de transformação isobárica. As relações entre volume e temperatura podem ser representadas pelo esquema:
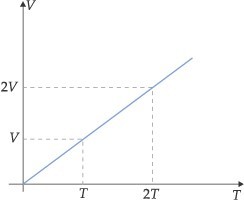
Graficamente, encontramos:
A reta obtida é representada pela equação: V = (constante) · T ou V/T = constante
Com isso, ficamos com:
Lei de Charles/Gay-Lussac
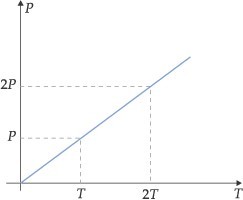
“A volume constante, a pressão exercida por uma determinada massa fixa de gás é diretamente proporcional à temperatura absoluta.”
Esta transformação gasosa, onde o volume é mantido constante, é denominada de transformação isocórica, isométrica ou isovolumétrica. As relações entre pressão e temperatura são representadas a seguir:
Graficamente, encontramos:
A reta obtida é representada pela equação: P = (constante) · T ou P/T = constante
Com isso, ficamos com:
Gás Perfeito ou Ideal
Obedece rigorosamente às Leis Físicas dos Gases em quaisquer condições de temperatura e pressão.
Gás Real
Não segue o comportamento do gás ideal, principalmente em pressões muito altas e/ou em temperaturas baixas, porque ocorre alta redução de volume e as partículas, muito próximas, passam a interferir umas no movimento das outras. Um gás real aproxima-se do comportamento de um gás ideal à medida que diminui a pressão e aumenta a temperatura.
Equação Geral dos Gases
Esta equação é utilizada quando ocorre transformação gasosa em que as três variáveis de estado (P, V e T) se modificam simultaneamente. Ela é obtida por meio da relação matemática entre as transformações gasosas estudadas anteriormente.
Condições Normais de Temperatura e Pressão (CNTP, CN ou TPN)
São definidas como condições normais de temperatura e pressão quando o gás é submetido a uma pressão de 1 atm e à temperatura de 0 °C. Portanto, podemos colocar:
P = 1 atm = 760 mmHg
T = 0 °C = 273 K
“Volumes iguais de gases quaisquer, à mesma temperatura e pressão, encerram o mesmo número de moléculas”
Lei de Avogadro
Sendo n a quantidade em mols de cada gás, podemos concluir que:
Determinou-se experimentalmente o volume ocupado por 1 mol de qualquer gás nas CNTP e foi encontrado o valor aproximadamente igual a 22,4 L. Portanto, podemos dizer que:
Equação de Clapeyron
As leis de Boyle e Charles/Gay-Lussac podem ser combinadas com a lei de Avogadro para relacionar volume, pressão, temperatura e quantidade em mols de um gás. Tal relação é chamada de equação de estado de um gás. Ela pode ser encontrada das seguintes formas:
Lei de Boyle-Mariotte
V é proporcional a quando T e n são constantes.
Lei de Charles/Gay-Lussac
V é proporcional a T onde P e n são constantes.
P é proporcional a T onde V e n são constantes.
Lei de Avogadro
V é proporcional a n quando T e P são constantes. Agrupando as quatro expressões encontramos:
V é proporcional a · (T) · (n) ou
V = R · · (T) · (n), onde R representa a constante de proporcionalidade e é chamada de constante universal dos gases. A equação de estado pode então ser representada por:
Esta equação também é denominada de equação de Clapeyron, em homenagem ao físico francês que a determinou. A constante R pode assumir dois valores distintos, de acordo com a unidade de pressão utilizada, dentre os quais temos:
Misturas gasosas
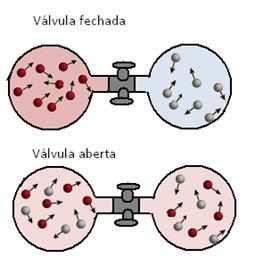
As misturas gasosas são muito comuns no cotidiano. É possível descobrir sua pressão e volume total através das pressões e volumes parciais dos gases componentes da mistura.
Estamos cercados mais por misturas de gases do que por gases isolados. O ar que respiramos é um exemplo de mistura de vários gases, sendo que os principais são o nitrogênio (N2), que corresponde a cerca de 80% do ar; e o oxigênio (O2), que é quase 20%.
Visto que são tão presentes em nosso cotidiano, é necessário analisar duas grandezas importantes quando se trata de misturas gasosas, que são: pressão parcial e volume parcial. A seguir, ambos serão explicados:
1. Pressão parcial dos gases:
A pressão parcial de um gás é a pressão que ele exerceria se estivesse sozinho, nas mesmas condições de temperatura e volume da mistura.
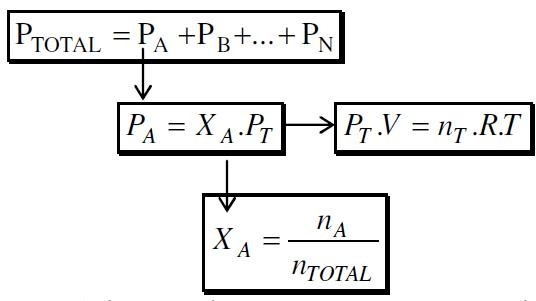
Segundo Dalton, a soma das pressões parciais dos gases que formam a mistura resulta na pressão total (p) da mistura. Por exemplo, se a pressão do ar for de 1,0 atm, a pressão parcial do N2 será de 0,8 (80% da pressão total) e a pressão parcial de O2 será igual a 0,2 % (20% da pressão total da mistura).
Essa Lei de Dalton é mostrada também pela fração em quantidade de matéria (X). Essa fração no caso do nitrogênio é dada por 0,8 mol.
1,0 mol
PN2= p . XN2
PN2= 1,0 atm . 0,8 = 0,8 atm.
Pode-se também calcular cada pressão parcial por meio da equação de estado dos gases:
Equação de estado dos gases: PV = nRT
2.Volume parcial dos gases:
Similarmente à pressão parcial, o volume parcial corresponde ao volume que um gás ocupa nas condições de temperatura e pressão da mistura.
A Lei de Amagat diz que a soma dos volumes parciais é igual ao volume total, assim como o caso da pressão visto anteriormente. Por isso, usamos a equação de estado dos gases, com a única diferença que agora se coloca o volume parcial do gás e não a pressão:
Também é possível calcular o volume parcial de cada gás componente da mistura por meio da fração em quantidade de matéria.
E ai gostou? Ou melhor, compreendeu um pouco sobre o comportamento e a equação dos gases?
Usamos este post para auxiliar seus estudos e facilitar sua compreensão.
Boa sorte em sua caminhada rumo a aprovação em um concurso público!!

Somos o Instituto Maximize de Educação, uma empresa especializada na preparação de Apostilas em PDF e Cursos Online para Concursos Públicos e Vestibulares.