Gabarite as questões que envolvem os conceitos e usos da tabela periódica
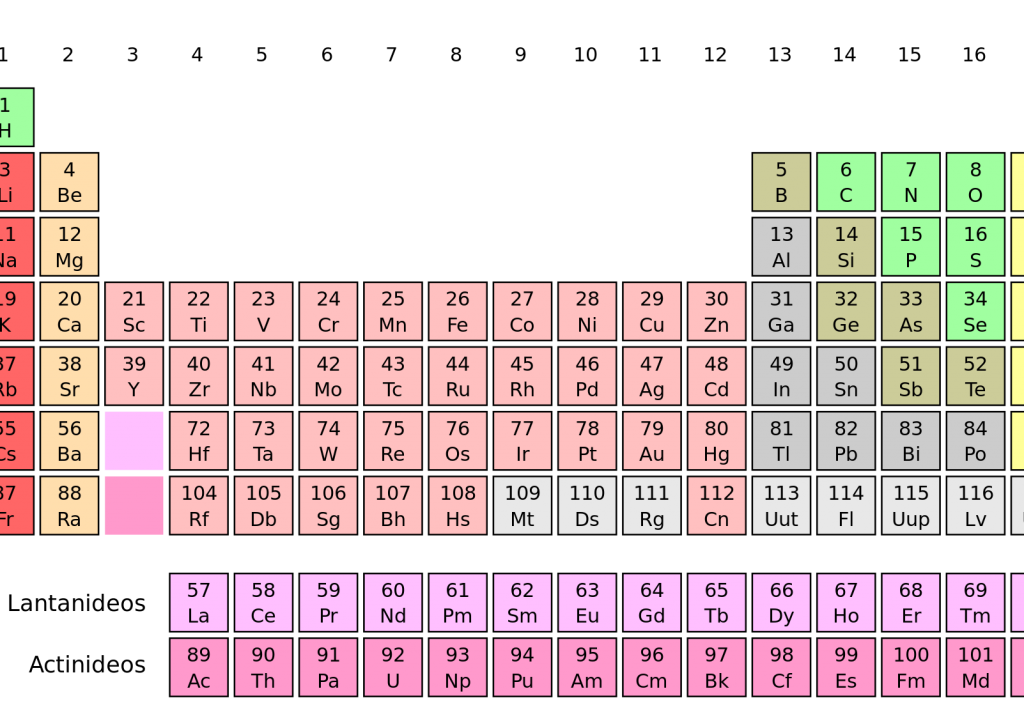
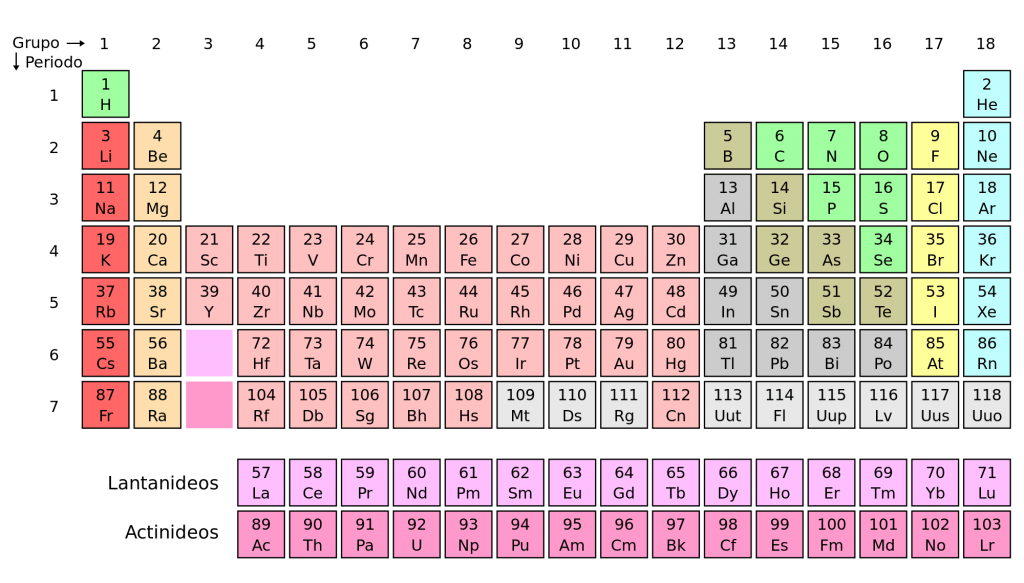
Na Tabela periódica atual: Os elementos são agrupados em ordem crescente de seu número atômico (Z), observando-se a repetição periódica de muitas de suas propriedades.
Como utilizar a tabela periódica?
Cada quadro da tabela fornece os dados referentes ao elemento químico: símbolo, massa atômica, número atômico, nome do elemento, elétrons nas camadas e se o elemento é radioativo.
As colunas verticais constituem as famílias ou grupos, nas quais os elementos estão reunidos segundo suas propriedades químicas.
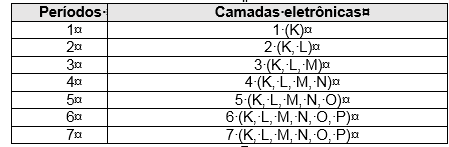
As filas horizontais são denominadas períodos. Neles os elementos químicos estão dispostos na ordem crescente de seus números atômicos. O número da ordem do período indica o número de níveis energéticos ou camadas eletrônicas do elemento.
Famílias ou Grupos
As Famílias da Tabela Periódica são distribuídas de forma vertical, em 18 colunas. Os elementos químicos que estão localizados na mesma coluna da Tabela Periódica são considerados da mesma família pois possuem propriedades físicas e químicas semelhantes. Esses elementos fazem parte de um mesmo grupo porque apresentam a mesma configuração de elétrons na última camada.
A tabela periódica atual é constituída por 18 famílias. A numeração das Famílias da Tabela Periódica se inicia no 1A (representado em nossa tabela periódica com o número 1) e continua até o zero ou 8A (representado em nossa tabela periódica pelo número 18). Existe também a Família B.
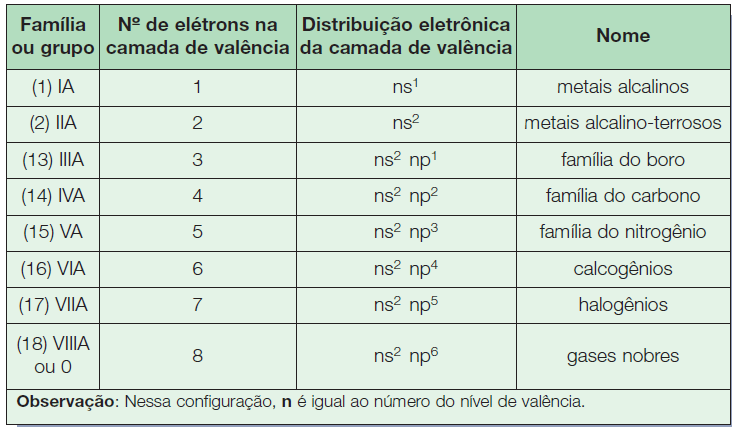
-Famílias A ou zero
Os elementos que constituem essas famílias são denominados elementos representativos, e seus elétrons mais energéticos estão situados em subníveis s ou p. Nas famílias A, o número da família indica a quantidade de elétrons na camada de valência. Elas recebem ainda nomes característicos.
Famílias B
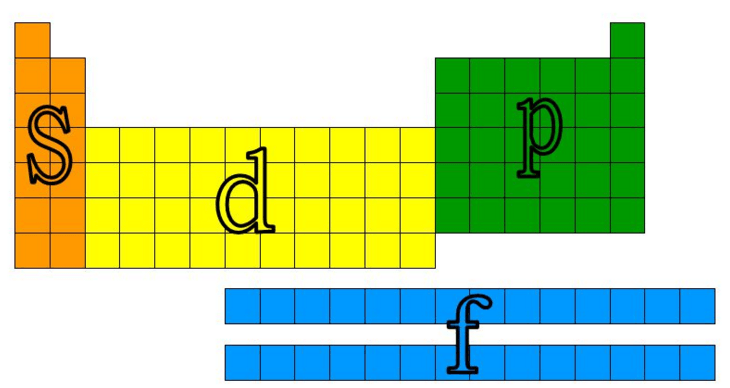
Os elementos dessas famílias são denominados genericamente elementos de transição. Uma parte deles ocupa o bloco central da tabela periódica, de IIIB até IIB (10 colunas), e apresenta seu elétron mais energético em subníveis d.
A outra parte deles está deslocada do corpo central, constituindo as séries dos lantanídeos e dos actinídeos. Essas séries apresentam 14 colunas. O elétron mais energético está contido em subnível f (f1 a f14).
O esquema a seguir, mostra o subnível ocupado pelo elétron mais energético dos elementos da tabela periódica.
Períodos ou séries
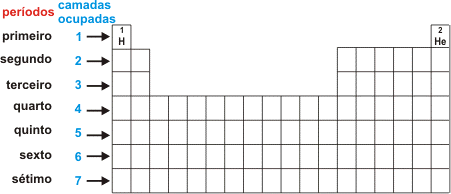
Cada fila horizontal da tabela periódica constitui o que chamados de período ou série de elementos.
Cada período corresponde ao número de camadas eletrônicas existentes nos elementos que os constituem. Os períodos são sete conforme pode ser observado no esquema abaixo.
Vejamos agora alguns exemplos de localização na tabela periódica:
1H — 1s1 1° camada (K)
4Be — 1s2 2s2. 2° camada (K, L)
11Na— 1s2 2s2 2p6 3s1: 3°camada (K, L, M)
13Al — 1s2 2s2 2p6 3s2 3p1: 3° camada.
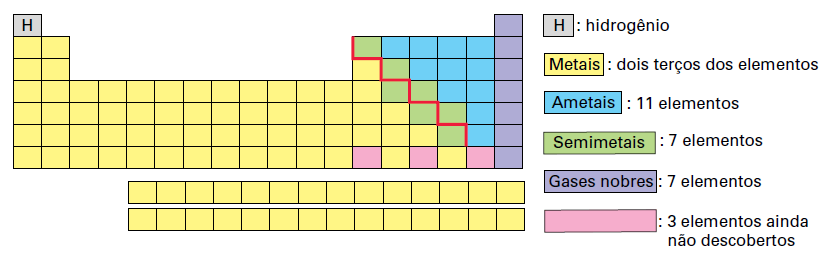
Outra maneira de classificar os elementos é agrupá-los, segundo suas propriedades físicas e químicas, em: metais, ametais, semimetais, gases nobres e hidrogênio.
Propriedades periódicas
As propriedades periódicas são aquelas que, à medida que o número atômico aumenta, assumem valores crescentes ou decrescentes em cada período, ou seja, repetem-se periodicamente. Exemplo: o número de elétrons na camada de valência.
Vamos agora detalhar algumas propriedades periódicas da Tabela.
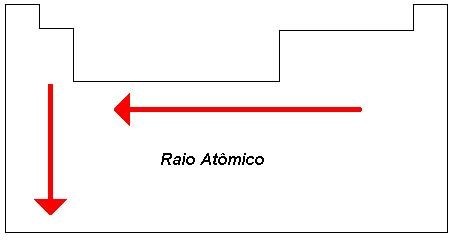
1. Raio atômico
O raio atômico é uma propriedade periódica difícil de ser medida. Pode-se considerar que corresponde à metade da distância (d) entre dois núcleos vizinhos de átomos do mesmo elemento químico ligados entre si.
Em uma família (grupo) tente a aumentar de cima para baixo (sentido em que aumenta também o número de camadas preenchidas pela eletrosfera de um átomo).
Em um período, o raio atômico tende a aumentar da direita para a esquerda. Isso ocorre porque o número de prótons e elétrons aumenta para a direita. Logo, no lado direito do período, os átomos têm o mesmo número de camadas, maior números de prótons e elétrons e, portanto, a força de atração entre eles é maior. Isso provoca uma contração da eletrosfera e a consequente diminuição do raio atômico.
2. Raio iônico
Quando um átomo ganha ou perde elétrons, transforma-se em íon. Nessa transformação, há aumento ou diminuição das dimensões do tamanho do átomo inicial.
– Raio de cátion: Quando um átomo perde elétron, a repulsão da nuvem eletrônica diminui, diminuindo o seu tamanho. Inclusive pode ocorrer perda do último nível de energia e quanto menor a quantidade de níveis, menor o raio.
Exemplo:
Portanto: raio do átomo > raio do cátion
Raio do ânion: quando um átomo ganha elétron, aumenta a repulsão da nuvem eletrônica, aumentando o seu tamanho.
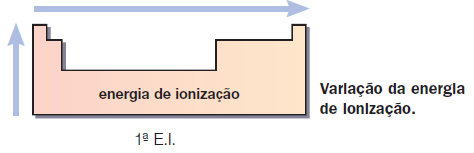
3.Energia de Ionização
A maior ou menor facilidade com que o átomo de um elemento perde elétrons é importante para a determinação do seu comportamento. Um átomo (ou íon) em fase gasosa perde elétron(s) quando recebe energia suficiente. Essa energia é chamada de energia (ou potencial) de ionização.
Quanto maior o raio atômico, menor será a atração exercida pelo núcleo sobre o elétron mais afastado; portanto, menor será a energia necessária para remover esse elétron.[1]
Ao retirarmos o primeiro elétron de um átomo, ocorre uma diminuição do raio. Por esse motivo, a energia necessária para retirar o segundo elétron é maior. Assim, para um mesmo átomo, temos:
1ª E.I. < 2ª E.I. < 3ª E.I.
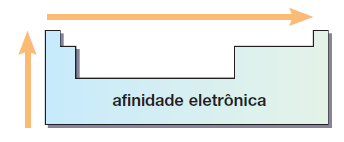
Afinidade eletrônica (AE) ou Eletroafinidade
A Eletroafinidade é a energia liberada quando um átomo isolado, no estado gasoso, “captura” um elétron.
X 0 (g) + e–à X– (g) + energia
Veja na tabela abaixo alguns valores conhecidos de eletroafinidade.
Resumindo… A variação da afinidade eletrônica na tabela periódica: aumenta de baixo para cima e da esquerda para a direita.
- Eletronegatividade e Eletropositividade
A eletronegatividade e a eletropositividade são duas propriedades periódicas que indicam a tendência de um átomo, numa ligação química, em atrair elétrons compartilhados. Ou ainda, podem representar a força com que o núcleo atrai a eletrosfera.
-Eletropositividade: tendência que um átomo tem de perder elétrons. É muito característico dos metais. Pode ser também chamado de caráter metálico. É o inverso da eletronegatividade.
A eletropositividade aumenta conforme o raio atômico aumenta.
-Eletronegatividade: a força de atração exercida sobre os elétrons de uma ligação.
Essa força de atração tem relação com o raio atômico: quanto menor o tamanho do átomo, maior será a força de atração, pois a distância núcleo-elétron da ligação é menor. A eletronegatividade não é definida para os gases nobres.
As variações de eletronegatividade podem ser representadas pela ilustração a seguir:
Importante:
Na tabela periódica, a eletronegatividade cresce de baixo para cima e da esquerda para a direita. A eletronegatividade relaciona-se com o raio atômico: de maneira geral, quanto menor o tamanho de um átomo, maior será a força de atração sobre os elétrons.
O cientista Linus Pauling propôs uma escala de valores para a eletronegatividade:
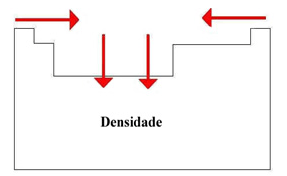
4. Densidade
Experimentalmente, verifica-se que:
a) Entre os elementos das famílias IA e VIIA, a densidade aumenta, de maneira geral, de acordo com o aumento das massas atômicas, ou seja, de cima para baixo.
b) Num mesmo período, de maneira geral, a densidade aumenta das extremidades para o centro da tabela.
Assim, os elementos de maior densidade estão situados na parte central e inferior da tabela periódica, sendo o ósmio (Os) o elemento mais denso (22,5 g/cm3).
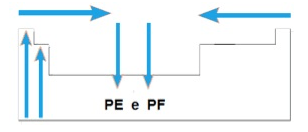
5.Temperatura de fusão (TF) e temperatura de ebulição (TE)
Experimentalmente, verifica-se que:
a) Nas famílias IA e IIA, os elementos de maiores TF e TE estão situados na parte superior da tabela. Na maioria das famílias, os elementos com maiores TF e TE estão situados geralmente na parte inferior.
b) Num mesmo período, de maneira geral a TF e a TE crescem das extremidades para o centro da tabela.
Assim, a variação das TF e TE na tabela periódica pode ser representada como no esquema acima.
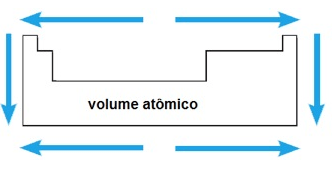
6. Volume atômico
Usamos a expressão “volume atômico”. Na verdade, usamos essa expressão para designar — para qualquer elemento — o volume ocupado por uma quantidade fixa de número de átomos.
O volume atômico sempre se refere ao volume ocupado por 6,02 x 1023 átomos, e pode ser calculado relacionando-se a massa desse número de átomos com a sua densidade.
Assim, temos:
Por meio de medidas experimentais, verifica-se que:
– numa mesma família, o volume atômico aumenta com o aumento do raio atômico;
– num mesmo período, o volume atômico cresce do centro para as extremidades.
De maneira geral, a variação do volume atômico pode ser representada pelo seguinte esquema:
E ai gostou deste post sobre tabela periódica?
Agora quero lhe convidar para deixar seu comentário com dúvidas, críticas ou sugestões sobre este artigo. Até a próxima!
[1] Usberco, J.; Salvador, E. 2002. Química. Editora Saraiva.

Somos o Instituto Maximize de Educação, uma empresa especializada na preparação de Apostilas em PDF e Cursos Online para Concursos Públicos e Vestibulares.








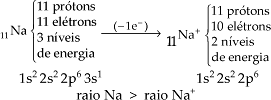



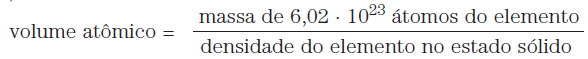
Eu queria saber, o que os elementos químicos vão formar na vertical?
Bom dia Dalyan. Obrigada por deixar sua participação em nosso blog. A união dos elementos organizados na vertical é chamada de Família. Caso não foi essa sua dúvida você pode reformular a pergunta e mandar para gente. Ah e temos mais posts sobre Química, acesse: https://blog.maxieduca.com.br/quimica/ Acompanhe-nos nas redes sociais. Facebook: https://goo.gl/fgnB61 Instagram: https://goo.gl/xe1LmU YouTube: https://goo.gl/REyOiW
Qual a massa do átomo de Pb ?
Oi Giovani, tudo bem? A massa do átomo de Pb (chumbo)é de 207,2. Um grande abraço e muito obrigado por seu comentário! Aproveite para nos acompanhar nas redes sociais: Facebook: https://goo.gl/fgnB61 Instagram: https://goo.gl/xe1LmU YouTube: https://goo.gl/REyOiW
Por que as camadas eletrônicas tem que ser definidas por K, L, M, N, O, P, Q? Tipo por que não A, B, C, D, E, F, G?
Olá Juliana, tudo bem? Não existe um motivo científico para as camadas começarem pela letra K. No início a denominação era por ordem alfabética, porém foram renomeadas com a intenção de ter opções de espaço para preencher com nomes para outras teorias que não vieram a ser provadas. O letra K foi escolhida para homenagear Lord Kelvin, famoso físico e matemático responsável pela criação da escala Kelvin. A partir da letra K como referência, foram nomeadas as camadas seguintes por ordem alfabética. Um grande abraço e muito obrigado por seu comentário! Aproveite para nos acompanhar nas redes sociais: Facebook: https://goo.gl/fgnB61 Instagram: https://goo.gl/xe1LmU YouTube: https://goo.gl/REyOiW